Tabelle chimico-fisiche Pubblicazioni liberamente consultabili, dove trovare tutti i dati sulle diverse sostanze, dalle proprietà fisiche, come il punto di ebollizione, a quelle chimiche, come la reattività

Valori delle costanti fisiche fondamentali.
Il sito delle Costanti Fisiche Fondamentali, curato dal NIST, riguarda tutte le costanti fisiche, e contiene molti dati di interesse per la Chimica. I valori sono continuamente aggiornati e sono quelli consigliati da CODATA, il Comitato per i Dati dello International Science Council.
https://physics.nist.gov/cuu/Constants/index.html
lingua: inglese

Per 100 anni, scienziati che lavorano in una varietà di campi, specialisti, ingegneri e studenti hanno usato Kaye e Laby come riferimento inestimabile per il loro lavoro. Al momento del lancio, questa versione online include l’intero contenuto inedito della 16a edizione (pubblicata nel 1995) ed è piena zeppa di tabelle di dati, formule, grafici e grafici. Queste informazioni spaziano da costanti fondamentali a fibre ottiche, superconduttività a spettroscopia Raman e molti altri. I contenuti saranno regolarmente rivisti e aggiornati per riflettere i progressi e gli sviluppi nei campi della fisica e della chimica.
https://web.archive.org/web/20170429201039/http:/www.kayelaby.npl.co.uk/toc#chem
lingua: inglese
Lange’s Handbook of Chemistry
Una ricchissima raccolta di dati di ogni tipo su proprietà chimiche e chimico-fisiche di composti organici, inorganici, e casi speciali.
http://fptl.ru/biblioteka/spravo4niki/dean.pdf
Lingua: inglese

Handbook of Chemistry and Physics
Il CRC Handbook of Chemistry and Physics è una risorsa di riferimento completa in un volume per la ricerca scientifica. Pubblicato per la prima volta nel 1914, è attualmente (a partire dal 2021) nella sua 102a edizione, pubblicata nel 2021. A volte è soprannominato la “Bibbia della gomma” o il “Libro della gomma”, poiché CRC originariamente stava per “Chemical Rubber Company”.
https://en.wikipedia.org/wiki/CRC_Handbook_of_Chemistry_and_Physics

8th Ed. (1920) versione on line
https://archive.org/details/HandbookOfChemistryAndPhysics8thEd.1920/mode/2up
Lingua: inglese

Statistica
- Distribuzione normale
La distribuzione normale (o distribuzione di Gauss) nella teoria della probabilità, è una distribuzione di probabilità continua che è spesso usata come prima approssimazione per descrivere variabili casuali a valori reali che tendono a concentrarsi attorno a un singolo valore medio.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Analytic_References/Appendix_03%3A_Single-Sided_Normal_Distribution
Contributors and Attributions fDavid Harvey (DePauw University)
lingua: inglese
- Valori critici per t-Test
Il test t (o, dall’inglese, t-test) è un test statistico di tipo parametrico con lo scopo di verificare se il valore medio di una distribuzione si discosta significativamente da un certo valore di riferimento.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Analytic_References/Appendix_04%3A_Critical_Values_for_t-Test
Collaboratori e attribuzioni: David Harvey (Università DePauw)
lingua: inglese
- Valori critici per l’F Test
In statistica il test F per il confronto di due varianze è un test di ipotesi basato sulla distribuzione F di Fisher-Snedecor e volto a verificare l’ipotesi che due popolazioni che seguono entrambe distribuzioni normali abbiano la stessa varianza.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Analytic_References/Appendix_05%3A_Critical_Values_for_the_F-Test
Collaboratori e attribuzioni: David Harvey (Università DePauw)
lingua: inglese
- Valori critici per il Q-Test di Dixon
Il test Q o test di Dixon (Q test in inglese) è un semplice test statistico non parametrico utilizzato per valutare se scartare o meno dati ritenuti outlier.
http://Appendice 06: Valori critici per il Q-Test di Dixon – Chemistry LibreTexts
Collaboratori e attribuzioni David Harvey (Università DePauw)
lingua: inglese
- Valori critici per il test di Grubb
In statistica, il test di Grubbs (prende il nome da Frank E. Grubbs, che pubblicò il test nel 1950), noto anche come massimo normalizzato residuo test o test di deviazione studentizzato estremo, è un test utilizzato per rilevare valori anomali in un set di dati univariato che si presume provenga da popolazione che segua la distribuzione normale.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Analytic_References/Appendix_07%3A_Critical_Values_for_Grubbs_Test
Collaboratori e attribuzioni David Harvey (Università DePauw)
lingua: inglese
Analisi Chimica
Uno standard primario, in Chimica analitica, è una sostanza la cui quantità può essere determinata con grande precisione. Deve essere una sostanza di elevata purezza: la percentuale di impurezze deve introdurre un errore trascurabile; un livello considerato spesso ottimale è ± 0.1% (cioè purezza NON inferiore al 99.9% in peso). Sono da scartare ad esempio tutte le sostanze igroscopiche o efflorescenti, i sali idrati con contenuto d’acqua incerto, sostanze ossidabili all’aria o alterabili dalla CO2. Altre caratteristiche desiderabili sono che la sostanza sia stabile nel tempo, non tossica, facilmente ottenibile con la purezza necessaria, di basso costo, e abbia peso formula elevato, in modo da minimizzare l’errore sul numero di moli dovuto agli errori di pesata. ttps://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Analytic_References/Appendix_08%3A_Recommended_Primary_Standards
Fonti: (a) Smith, B. W.; Parsons, M. L. J. Chem. Educ. 1973, 50, 679-681; b) Moody, J. R.; Greenburg, P. R.; Pratt, K. W.; Rains, T.C. Anal. Chem. 1988, 60, 1203A-1218A.
lingua: inglese
Proprietà atomiche
La configurazione elettronica di un atomo (o di una specie molecolare) è la distribuzione degli elettroni in un set di orbitali. Nella tabella sono riportate le configurazioni elettroniche degli atomi isolati allo stato fondamentale.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Atomic_and_Molecular_Properties/A1%3A_Atomic_Electron_Configurations
lingua: inglese
L’elettronegatività è la tendenza di un atomo ad attrarre elettroni condivisi. Così definita, è una proprietà qualitativa, ma sono state tentate diverse definizioni quantitative. Quelle più note, e più frequentemente usate, sono le scale di elettronegatività di Pauling e di Mulliken. La tabella riporta i valori di elettronegatività secondo diverse scale, per gli elementi degli 8 gruppi principali. https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Atomic_and_Molecular_Properties/A2%3A_Electronegativity_Values
lingua: inglese
Il raggio covalente è la dimensione di un atomo impegnato in un legame covalente. La lunghezza di legame è la somma dei raggi covalenti dei due atomi. La tabella riporta i raggi covalenti di tutti gli elementi, che possono essere diversi a seconda del tipo di legame.https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Atomic_and_Molecular_Properties/A3%3A_Covalent_Radiihttps://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Atomic_and_Molecular_Properties/A3%3A_Covalent_Radii
lingua: inglese
- Raggio metallico
il raggio metallico è definito come la metà della distanza tra due atomi metallici adiacenti in un solido metallico. Questo raggio dipende dalla natura dell’atomo e dal suo numero di coordinazione all’interno del reticolo. https://chem.libretexts.org/Courses/Bellarmine_University/BU%3A_Chem_103_(Christianson)/Phase_3%3A_Atoms_and_Molecules_-_the_Underlying_Reality/8%3A_Periodic_Trends_in_Elements_and_Compounds/8.2%3A_Atomic_and_Ionic_Radius
lingua: inglese
Il peso atomico è la massa media di un atomo di un elemento. La sua unità nel sistema SI è g/mol , ma a volte si preferisce considerare la massa atomica relativa, che è adimensionale e ha lo stesso valore. Poiché gli elementi sono costituiti da isotopi di massa diversa, il peso atomico è la media pesata delle masse dei vari isotopi.Nella tabella sono riportati la composizione isotopica di tutti gli elementi e i pesi atomici standard
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Atomic_and_Molecular_Properties/A4%3A_Atomic_Weights_and_Isotope_Composition
lingua: inglese
La tabella riporta il momento di dipolo della molecola di numerose sostanze in fase liquida, gassosa o disciolte in benzene.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Atomic_and_Molecular_Properties/A5%3A_Dipole_Moments
lingua: inglese
L’energia di ionizzazione è la minima energia richiesta per strappare un elettrone da un atomo (o molecola) neutro (prima energia) o da uno ione +1, +2, … (seconda, terza, …). Nella tabella sono riportate le energie di ionizzazione, dalla prima alla decima, degli atomi di tutti gli elementi.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Atomic_and_Molecular_Properties/A6%3A_Atomic_Ionization_Energies
lingua: inglese
L’affinità elettronica è comunemente definita come l’energia rilasciata quando viene aggiunto un elettrone ad un atomo neutro (IUPAC Goldbook). Nelle tabelle sono riportate le energie di affinità elettronica di tutti gli elementi riportate sia in eV/mol che in kJ/mol
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Atomic_and_Molecular_Properties/A7%3A_Electron_Affinities
lingua: inglese
L’equazione di van der Waals modifica la legge dei gas perfetti per riprodurre il comportamento dei gas reali. L’equazione introduce due costanti a e b (dette costanti di van der Waals), che dipendono dalla sostanza in esame. Nella tabella sono riportate le costanti di van der Waals di numerose sostanze gassose.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Atomic_and_Molecular_Properties/A8%3A_van_der_Waal’s_Constants_for_Real_Gases
lingua: inglese
- Secondo coefficiente dell’equazione del viriale
Il comportamento di un gas reale, quando si allontana da quello del gas ideale, può essere descritto in modo accurato, specialmente ad alta pressione e a bassa temperatura, dall’equazione di stato detta equazione del viriale, che è uno sviluppo in serie di potenze del volume molare v
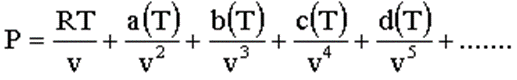
I termini a(T), b(T), c(T), d(T),….sono detti coefficienti del viriale; essi possono essere determinati sperimentalmente o teoricamente dalla Meccanica statistica. https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Atomic_and_Molecular_Properties/A9%3A_Second_Virial_Coefficients
Lingua : inglese
- Valori della funzione di lavoro
Il lavoro di estrazione o funzione lavoro (da non confondere col concetto generale di lavoro in fisica) è l’energia minima che occorre fornire per estrarre un singolo elettrone da un metallo solido. Questa energia dipende dal metallo e si aggira in genere intorno a qualche elettronvolt. I valori possono variare a seconda dell’orientazione della struttura cristallina e della purezza del metallo. Le tabelle riportano i valori per diversi metalli. https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Bulk_Properties/B1%3A_Workfunction_Values_(Reference_Table)
Fonti: CRC handbook on Chemistry and Physics version 2008, p. 12-114 https://it.wikipedia.org/wiki/Lavoro_di_estrazione
Lingua : inglese, italiano
Tabelle termodinamiche
Calore specifico e capacità termica molare Sono forniti i calori specifici e le capacità termiche molari per un piccolo numero di elementi e di composti https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Thermodynamics_Tables/T4%3A_Specific_Heats_and_Molar_Heat_Capacities Lingua: inglese
Quantità termodinamiche standard
Quantità termodinamiche standard per sostanze chimiche a 25°C.
Substance (form) Enthalpy ΔfHo(kJ) Gibbs ΔfGo(kJ) Entropy So(J/K) Specific heatn cP(J/K Volume V(cm3)
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Thermodynamics_Tables/T1%3A_Standard_Thermodynamic_Quantities
Fonte dei dati: CRC Handbook of Chemistry and Physics, 84a edizione (2004).
Lingua: inglese
Proprietà termodinamiche delle sostanze
La tabella contiene entalpia, energia libera, entropia, calore specifico e volume specifico, in condizioni standard, di alcune sostanze.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Thermodynamics_Tables/T2%3A_Extended_Thermodynamic_Properties_of_Substances
Lingua: inglese
Entalpia di vaporizzazione
In termodinamica, per ogni transizione di fase (o “passaggio di stato”), si definisce il calore latente o entalpia di transizione, indicato con col simbolo λ, la lettera greca lambda, che è la quantità di energia scambiata durante lo svolgimento della transizione.L’entalpia di vaporizzazione (o calore di ebollizione) ∆vap H è una proprietà fisica di una sostanza, definita come l’energia richiesta per vaporizzare una mole della sostanza liquida, al suo punto di ebollizione e a pressione standard (101.325 Pa). L’entalpia di vaporizzazione viene espressa nel SI in kJ/mol. A volte si usa il calore di ebollizione a 25°C, o per unità di massa misurato in J/g. Le tabelle riportano numerosi ∆vap H, sempre alla pressione di 103.325 Pa, alla temperatura di ebollizione o a 25°C, in kJ/mol o in J/g https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Bulk_Properties/B2%3A_Heats_of_Vaporization_(Reference_Table)
Fonti: “Physical Constants of Organic Compounds”, in CRC Handbook of Chemistry and Physics, 102nd Edition (Internet Version 2021), John R. Rumble, ed., CRC Press/Taylor & Francis, Boca Raton, FL.
https://it.wikipedia.org/wiki/Entalpia_di_vaporizzazione
Lingua : inglese, italiano
Entalpia di fusione
L’entalpia di fusione, o calore latente di fusione, è l’energia corrispondente al passaggio di un sistema, costituito da una a più sostanze chimiche, dallo stato solido a quello liquido. Nelle tabelle sono riportati i calori latenti di alcune sostanze, o miscele di sostanze, in J/g.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Bulk_Properties/B3%3A_Heats_of_Fusion_(Reference_Table)
https://it.wikipedia.org/wiki/Calore_latente
Lingua : inglese, italiano
- Costanti della legge di Henry
La legge di Henry dice che a temperatura costante, la solubilità di un gas è direttamente proporzionale alla pressione parziale che il gas esercita sulla soluzione.
C = k P
C solubilità (concentrazione del gas nella soluzione satura) P pressione parziale del gas k costante di Henry. Nel riportare i valori di k, si usano spesso unità ormai obsolete: C in mol/L o in mL di gas/L; P in atm; k in mol/(L atm). Raggiunto l’equilibrio, il liquido si definisce saturo di quel gas a quella pressione.Nella tabella sono riportate le costanti della legge di Henry per alcuni gas in acqua a 298 K. https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Bulk_Properties/B4%3A_Henry’s_Law_Constants
https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Physical_Properties_of_Matter/Solutions_and_Mixtures/Ideal_Solutions/Dissolving_Gases_In_Liquids%2C_Henry’s_Law
Lingua: inglese
Costanti ebullioscopiche
L‘innalzamento ebullioscopico è la differenza tra la temperatura di ebollizione di un solvente puro e quella di una soluzione in cui sia presente tale solvente.
ΔTeb = Keb. b per soluzioni di non elettroliti
ΔTeb = Keb. b . i per soluzioni di elettroliti
dove Keb è la costante ebullioscopica, b la molalità, i il coefficiente di van’t Hoff (o fattore di dissociazione). La concentrazione b si esprime come molalità perché così è indipendente dalla temperatura . La costante ebullioscopica è una proprietà caratteristica del solvente e non del soluto in una soluzione.. https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Bulk_Properties/B5%3A_Ebullioscopic_(Boiling_Point_Elevation)_Constants
Lingua : inglese
- Costanti crioscopiche
L’abbassamento crioscopico è la differenza tra la temperatura di congelamento di un solvente puro e quella del solvente da una sua soluzione.
ΔTc = Kc. b per soluzioni di non elettroliti
ΔTc = Kc. b . i per soluzioni di elettroliti
dove Kc è la costante crioscopica , b la molalità, i Il coefficiente di van’t Hoff (o fattore di dissociazione). La concentrazione b si esprime come molalità perché così è indipendente dalla temperatura. La costante crioscopica è un proprietà caratteristica del solvente e non del soluto in una soluzione. https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Bulk_Properties/B6%3A_Cryoscopic_(Melting_Point_Depression)_Constants
Lingua: inglese
Potenziali di riduzione standard
Tabelle della serie elettrochimica, di Petr Vanýsek. Elencano i potenziali di riduzione standard, valori E°, a 298.15 K (25° C), rispetto dell’elettrodo standard ad idrogeno, prima in ordine alfabetico e poi in ordine di potenziale.
https://chclab-chem.nsysu.edu.tw/static/file/179/1179/img/3241/TablasdepotencialesREDOX_PhysChemhandbook.pdf
lingua: inglese
Potenziali di riduzione standard per elemento
Nelle tabella seguente sono forniti i valori di E0 ed E0′ per alcune reazioni di riduzione. Le sostanze solide, liquide o gassose sono precisate; tutte le altre specie sono acquose.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Electrochemistry_Tables/P1%3A_Standard_Reduction_Potentials_by_Element
I valori provengono dalle seguenti fonti: Bard, A. J.; Parsons, B.; Jordon, J., eds. Standard Potentials in Aqueous Solutions, Dekker: New York, 1985; Milazzo, G.; Caroli, S.; Sharma, V. K. Tables of Standard Electrode Potentials, Wiley: Londra, 1978; Swift, E. H.; Butler, E. A. Quantitative Measurements and Chemical Equilibria, Freeman: New York, 1972.
Lingua: inglese
Potenziali di riduzione standard per valore
rta i valori di Eo per reazioni di riduzione selezionate. La tabella è ordinata in modo tale che i riducenti più forti (più reattivi) siano in alto e gli ossidanti più forti siano in basso.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Electrochemistry_Tables/P2%3A_Standard_Reduction_Potentials_by_Value
Fonti: Bard, A. J.; Parsons, B.; Jordon, J., eds. Standard Potentials in Aqueous Solutions, Dekker: New York, 1985; Milazzo, G.; Caroli, S.; Sharma, V. K. Tables of Standard Electrode Potentials, Wiley: Londra, 1978; Swift, E. H.; Butler, E. A. Quantitative Measurements and Chemical Equilibria, Freeman: New York, 1972.
Lingua: inglese
Serie di attività dei metalli
Serie di attività di alcuni dei metalli più comuni, elencati in ordine decrescente di reattività. Viene utilizzato per determinare i prodotti delle reazioni di spostamento singolo, per cui il metallo A sostituirà un altro metallo B in una soluzione se A è più alto nella serie.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Electrochemistry_Tables/P3%3A_Activity_Series_of_Metals
Fonte di Stephen Lower Professore Emerito (Chimica) presso Simon Fraser University
Lingua: inglese
Potenziali polarografici a mezza onda
Nella tabella seguente viene fornito E1/2 valori per reazioni di riduzione selezionate.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Electrochemistry_Tables/P4%3A_Polarographic_Half-Wave_Potentials
I valori sono tratti da Dean, J. A. Analytical Chemistry Handbook, McGraw-Hill: New York, 1995.
Lingua: inglese
Costanti di equilibrio
Costanti di dissociazione acida a 25°C
La tabella contiene le costanti di dissociazione Ka e i corrispondenti pKa per la prima dissociazione, e per le successive, di numerosi acidi. https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Equilibrium_Constants/E1%3A_Acid_Dissociation_Constants_at_25C
Fonte dei dati: CRC Handbook of Chemistry and Physics, 84a edizione (2004)
Lingua: inglese
Costanti di dissociazione della base a 25°C
La tabella contiene le costanti di dissociazione Kb e i corrispondenti pKb per diverse basi. https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Equilibrium_Constants/E2._Base_Dissociation_Constants_at_25C
Fonte dei dati: CRC Handbook of Chemistry and Physics, 84a edizione (2004).
Lingua: inglese
Costanti di dissociazione di acidi deboli
La tabella fornisce i valori di pKa e Ka valori per diverse coppie acido-base deboli. Salvo diversa indicazione, i valori sono a 25oC e forza ionica zero.La tabella riporta solo la forma acida (protonata) della coppia, sia essa neutra o con carica. Per avere la costante basica della base coniugata, si può usare la formula riportata.Per gli acidi poliprotici sono riportate le costanti di dissociazione successive.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Equilibrium_Constants/E5%3A_Acid_Dissociation_Constants_of_Organics
Tutti i valori provengono da Martell, A. E.; Smith, R.M. Critical Stability Constants, Vols. 1–4. Plenum Press: New York, 1976.
Lingua: inglese
Solubilità
Sebbene tutti i composti abbiano una solubilità caratteristica in acqua ad una data temperatura, alcune famiglie di composti sono più solubili di altre ed è utile conoscere alcune regole generali di solubilità. Chiamiamo qualsiasi sostanza insolubile la sua solubilità è inferiore a 0,01 mol/L. Se la sua solubilità è maggiore di 0,1 mol/L, la chiamiamo solubile. Se la sua solubilità è compresa tra 0,01 e 0,1 mol/L, diciamo che è leggermente solubile. Le seguenti regole di solubilità possono essere utilizzate per determinare le solubilità in acqua, con il disclaimer che non sempre reggono, né includono ogni ione che è di uso comune, ma sono buone da avere nelle vicinanze quando necessario:
- Tutti i sali di sodio, potassio e ammonio sono solubili.
- Tutti i nitrati, acetati e perclorati sono solubili.
- Tutti i sali di argento, piombo e mercurio (I) sono insolubili.
- Tutti i cloruri, bromuri e iodi sono solubili.
- Tutti i carbonati, solfuri, ossidi e idrossidi sono insolubili.
- Tutti i solfati sono solubili tranne il solfato di stronzio e il solfato di bario.
Costanti di solubilità per composti a 25°C
La tabella contiene, oltre alle costanti, una serie di regole generali per prevedere la solubilità. https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Equilibrium_Constants/E3._Solubility_Constants_for_Compounds_at_25C
Fonte dei dati: CRC Handbook of Chemistry and Physics, 84a edizione (2004); i dati sui solfuri sono da Lange’s Handbook of Chemistry, 15th Edition (1999).
Lingua: inglese
Costanti di formazione di ioni complessi
Una costante di stabilità è una costante di equilibrio per la formazione di un complesso in soluzione che misura la forza dell’interazione tra i ligandi e il metallo che formano il complesso. La formazione di complessi tra uno ione metallico, M, e ligandi, L, è in realtà uno scambio di ligandi (cioè una reazione di sostituzione) con ioni metallici in soluzioni acquose presenti come ioni acqua-legati.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Equilibrium_Constants/E4%3A_Complex_Ion_Formation_Constants
Lingua: inglese
Costanti successive di associazione di complessi
La tabella fornisce, per alcuni complessi e ordinate per ligando, la prima e le successive costanti di associazione tra ligando e ioni metallici.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Equilibrium_Constants/E4a%3A_Stepwise_Association_Constants
Fonte Martell, A. E.; Smith, R.M. Critical Stability Constants, Vols. 1–4. Plenum Press: New York, 1976. Salvo diversa indicazione, i valori sono per 25 oC e forza ionica zero.
Lingua: inglese
Coefficienti di attività a 25°C
Il coefficiente di attività misura la deviazione di una sostanza dal comportamento ideale. La tabella riporta i coefficienti di attività di molti elettroliti. Poiché questi coefficienti dipendono molto dalla forza ionica totale della soluzione acquosa, sono riportati a diversi valori della forza ionica. https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Equilibrium_Constants/E6%3A_Activity_Coefficients_at_25C
Lingua: inglese
Indicatori acido-basi
La tabella contiene una lista di indicatori acido-base. Per ciascuno, fornisce informazioni sul pH di viraggio, i colori e la preparazione.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Acid-Base_Indicators
Lingua: inglese
Simmetria molecolare . Tabelle dei gruppi
Tavole dei caratteri dei gruppi puntuali di simmetria
La tavola contiene le caratteristiche dei gruppi di simmetria puntuali, cioè quelli applicabili a molecole finite, escludendo quelli che contengono simmetrie di traslazione, che danno luogo a strutture infinite (cristalli). Qualsiasi molecola è definita da uno di questi gruppi, le cui caratteristiche possono essere importanti in studi avanzati, per es. di spettroscopia.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Group_Theory_Tables/Character_Tables
Lingua: inglese
Tabelle dei gruppi di simmetria per composti inorganici
Questa tavola, dichiarata ancora in costruzione, è di incerta interpretazione e utilità. Non spiega infatti perché si riferisca a composti organici, dato che i caratteri dei gruppi sono un concetto matematico, indipendente dall’oggetto a cui si applicano.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Group_Theory_Tables/Character_Tables_(Inorganic)
Lingua: inglese
Tabelle dirette dei prodotti
Queste tavole si riferiscono a proprietà dei gruppi, i prodotti diretti degli elementi di simmetria. Hanno interesse solo specialistico, per studi teorici o applicati delle proprietà di simmetria.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Group_Theory_Tables/Direct_Product_Tables
Lingua: inglese
Tabelle nucleari
Tempi di dimezzamento di alcuni isotopi radioattivi
Il tempo di dimezzamento, o emivita, di un isotopo radioattivo è il tempo occorrente per ridurre alla metà la radiazione emessa, quindi per far scomparire la metà del numero iniziale di particelle. La legge esponenziale di decadimento dell’attività A è A = A0e-kt. Il tempo di dimezzamento t1/2 è legato alla costante k dalla relazione t1/2k = 0.693
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Nuclear_Tables/N1%3A_Half-Lives_for_Several_Radioactive_Isotopes
Lingua: inglese
Tabelle spettroscopiche
Spostamenti (chemical shift) nell’NMR 13C dovuti al solvente
La tabella elenca gli spostamenti (chemical shift) nell’NMR col carbonio 13 dei comuni solventi e impurezze di laboratorio. https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Spectroscopic_Parameters/(13C)_solvent_shifts
Lingua: inglese
Tabella di assorbimento della spettroscopia infrarossa
La seguente tabella elenca gli assorbimenti per spettroscopia infrarossa per regioni di frequenza.
https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Spectroscopic_Parameters/Infrared_Spectroscopy_Absorption_Table
Lingua: inglese
Spostamenti (chemical shift) nell’NMR 1H dovuti al solvente
La tabella elenca gli spostamenti (chemical shift), per l’NMR protonico, dei comuni solventi e impurezze di laboratorio. https://chem.libretexts.org/Ancillary_Materials/Reference/Reference_Tables/Spectroscopic_Parameters/(1H)_NNR_Solvent_Shifts
Lingua: inglese
 Note di Chimica
Note di Chimica
Solventi. Elenco e proprietà
La pagina contiene diverse tabelle, con un elenco esteso di solventi, e loro proprietà
http://www.notedichimica.altervista.org/solventi.html
Lingua: italiano
Tabella pKa Composti organici
La pagina contiene diverse tabelle, con un esteso elenco di acidi e del loro pKa, che ne indica la forza. Include anche composti con proprietà acide debolissime.
http://notedichimica.altervista.org/pka-dei-principali-composti-organici.html
Lingua: italiano
Tabella Amminoacidi
Tabella dei 20 amminoacidi che costituiscono normalmente le proteine, con nomi, formule e proprietà
http://www.notedichimica.altervista.org/amminoacidi.html
Lingua: italiano
Tabella Nomenclatura Composti Eterociclici
Tabella dei nomi dei principali nuclei eterociclici. I nomi sono quelli comunemente usati, non quelli della nomenclatura ufficiale. Per alcuni è indicata anche la numerazione degli atomi.
http://www.notedichimica.altervista.org/eterocicli.html
Lingua: italiano
Tabella 1H NMR – Chemical shift Solventi organici
Una serie di tabelle con i valori dei Chemical Shift di numerosi composti organici per la spettroscopia NMR del nucleo di Idrogeno (1H-NMR), con indicazione del solvente in cui sono misurati.
http://www.notedichimica.altervista.org/1h-nmr-chemical-shift-dei-solventi.html
Lingua: italiano
Tabella 1H NMR – Tabelle correlazione e Costante di accoppiamento
Contiene Tabelle di Correlazione e Costanti di accoppiamento per alcuni composti organici nella spettroscopia NMR del nucleo di Idrogeno (1H-NMR). Sono dati importanti per l’interpretazione degli spettri NMR.
http://www.notedichimica.altervista.org/1h-nmr-tavole-di-correlazione-e-costanti-di-accoppiamento.html
Lingua: italiano
Tabella 13C NMR – Chemical shift Solventi organici
La tabella contiene i valori dei Chemical Shift di alcuni solventi e solventi deuterati, per la spettroscopia NMR col Carbonio 13 (13C-NMR).
http://www.notedichimica.altervista.org/13c-nmr-chemical-shift-dei-solventi.html
Lingua: italiano
Tabella 13C NMR – Tabelle correlazione e Costante di accoppiamento
Contiene Tabelle di Correlazione e Costanti di accoppiamento per categorie di composti organici nella spettroscopia NMR col Carbonio 13 (13C-NMR). Sono dati importanti per l’interpretazione degli spettri NMR.
http://www.notedichimica.altervista.org/13c-nmr-tavole-di-correlazione-e-costanti-di-accoppiamento.html
Lingua: italiano
Tabella Spettrometria di Massa
Una serie di tabelle con dati utili per l’interpretazione di spettri della Spettrometria di Massa
http://www.notedichimica.altervista.org/spettrometria-di-massa.html
Lingua: italiano
Spettroscopia IR – Tavole di correlazione
Una serie di tabelle con informazioni sulle bande di assorbimento nella Spettroscopia Infrarossa (IR).
http://www.notedichimica.altervista.org/spettroscopia-ir.htmL
Lingua: italiano
Energie di legame
Le seguenti tabelle elencano le entalpie sperimentali di dissociazione dei legami comuni a 298 K.
https://www2.chemistry.msu.edu/faculty/reusch/OrgPage/tables.htm
fonti: R.T.Sanderson, Covalenza polare, 1983 R.T.Sanderson, Chemical Bonds and Bond Energy, 1976 William Reusch, Professore Emerito(Michigan State U.), Manuale Virtuale di Chimica Organica
Lingua: inglese
Gruppi Simmetria
Tavole dei caratteri per gruppi di punto chimicamente importanti
http://symmetry.jacobs-university.de/
lingua: inglese

Elementi chimici Tabella riportante simbolo, numero atomico, massa atomica, configurazione elettronica e principali numeri di ossidazione degli elementi.
https://www.reteissa.it/chimica/tabelle/elementi.html
lingua: italiano

Costanti di solubilità Le costanti, o prodotti di solubilità, dei principali sali insolubili
https://www.reteissa.it/chimica/tabelle/costantisolubilit%C3%A0.html https://it.wikipedia.org/wiki/Costante_di_solubilit%C3%A0
lingua: inglese

Costanti di dissociazione acida a 25° C Le costanti acide dei principali acidi monoprotici e poliprotici. La forza ionica è zero per la maggior parte dei dati.
https://www.reteissa.it/chimica/tabelle/costantiacide.html
Lingua: italiano
Potenziali di riduzione standard
Ogni tabella elenca i potenziali di riduzione standard, valori E°, a 298.15 K (25° C). I valori sono riportati in ordine alfabetico nella tabella 1, mentre in tabella 2 e tabella 3 sono riportate le reazioni che hanno rispettivamente un potenziale di riduzione maggiore e minore rispetto dell’elettrodo standard ad idrogeno.
https://chclab-chem.nsysu.edu.tw/static/file/179/1179/img/3241/TablasdepotencialesREDOX_PhysChemhandbook.pdf
Fonti: 1. G. Milazzo, S. Caroli, and V. K. Sharma, Tables of Standard Electrode Potentials, Wiley, Chichester, 1978. 2. A. J. Bard, R. Parsons, and J. Jordan, Standard Potentials in Aqueous Solutions, Marcel Dekker, New York, 1985. 3. S. G. Bratsch, J. Phys. Chem. Ref. Data, 18, 1—21, 1989.
lingua: inglese

WikiBooks – Costanti di dissociazione acida
In Wikibooks, Laboratorio di chimica in casa, una estesa tabella di costanti di dissociazione di acidi di vari tipi. https://it.wikibooks.org/wiki/Laboratorio_di_chimica_in_casa/Costanti_di_dissociazione lingua: italiano

Costante di solubilità
Questa pagina di Wikipedia discute la costante, o prodotto, di solubilità. Si noti che i diversi valori riportati sono a varie Temperature, non sempre alla T standard di 25°C. https://it.wikipedia.org/wiki/Costante_di_solubilit%C3%A0
Lingua : italiano

Energie di legame standard ed energie di dissociazione di legame
Le tabelle elencano le entalpie di dissociazione standard di alcuni comuni legami.
https://www2.chemistry.msu.edu/faculty/reusch/OrgPage/bndenrgy.htm
Fonti Molte delle energie di legame qui elencate sono state prese dalle seguenti fonti:
R.T.Sanderson, Polar Covalence, 1983
R.T.Sanderson, Chemical Bonds and Bond Energy, 1976
Lingua: inglese
Tabelle di dati per solventi
Due tabelle con dati e proprietà di solventi, distinti in aprotici e protici.
https://www2.chemistry.msu.edu/faculty/reusch/OrgPage/solvent.htm
Lingua: inglese
Costanti di ionizzazione di acidi inorganici
Due tabelle con costanti di ionizzazione (o costanti di dissociazione acida) di acidi inorganici, distinti in monoprotici e poliprotici.
https://www2.chemistry.msu.edu/faculty/reusch/OrgPage/acidity.htm
Lingua: inglese
Costanti di ionizzazione di acidi organici
Due tabelle con costanti di ionizzazione (o costanti di dissociazione acida) di acidi organici. Gli acidi sono distinti secondo che il protone che si dissocia sia legato direttamente al Carbonio, o a un atomo di un altro elemento (come nel gruppo carbossile -COOH).
https://www2.chemistry.msu.edu/faculty/reusch/OrgPage/acidity2.htm
Lingua: inglese
Costanti di ionizzazione degli acidi coniugati di alcune basi
Un metodo comune per valutare la forza delle basi è quello di riportare le acidità degli acidi coniugati delle basi (questi acidi coniugati sono spesso cationi “onium”). I pKa risultanti sono proporzionali alla forza di base della base. Una regola utile è: pKa + pKb = 14. https://www2.chemistry.msu.edu/faculty/reusch/OrgPage/basicity.htm
Lingua: inglese
Differenze di energia libera per sostituenti assiali o equatoriali del cicloesano
Questa tabella riguarda gli effetti energetici di una variazione esclusivamente conformazionale: riporta le differenze di energia libera per alcuni sostituenti in posizione assiale o equatoriale sul cicloesano
https://www2.chemistry.msu.edu/faculty/reusch/OrgPage/confengy.htm
Lingua: inglese
Masse esatte e rapporti di abbondanza isotopica
Questa pagina, di interesse soprattutto per la spettrometria di massa, permette di calcolare la massa esatta di una molecola costituita da specifici isotopi, diversa dalla massa molecolare media, comunemente usata. Per alcuni dei più comuni elementi fornisce la massa e l’abbondanza dei diversi isotopi. Un calcolatore permette di calcolare la massa esatta di una molecola di data formula, formata solo dall’isotopo più abbondante di ciascuno degli elementi costituenti.
https://www2.chemistry.msu.edu/faculty/reusch/OrgPage/mass.htm
Lingua: inglese
Chemical Shift per lo NMR con protoni 1H e con carbonio 13C
La pagina contiene dati di Chemical Shift per la spettroscopia NMR, sia con protoni 1H, sia con carbonio 13C.
https://www2.chemistry.msu.edu/faculty/reusch/OrgPage/nmr.htm
Lingua: inglese

Energie conformazionali Questa pagina fornisce la differenza di energia libera fra la posizione assiale e quella equatoriale, per diversi sostituenti sul cicloesano. La differenza è dovuta solo a effetti conformazionali. Da questi dati è possibile calcolare la costante di equilibrio tra le due forme.
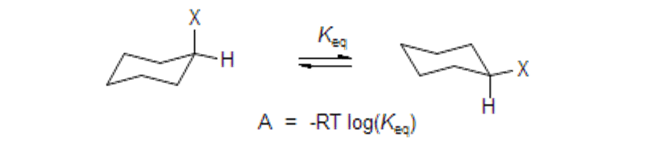
https://organicchemistrydata.org/hansreich/resources/fundamentals/?page=a_values/ Lingua: inglese
Tabella unità di misura
Una tabella delle principali unità di misura del Sistema Internazionale SI, con una presentazione molto semplice del Sistema
https://www.chimica-online.it/download/tabella-unita-di-misura.htm
lingua: italiano
Prefissi per multipli e sottomultipli delle unità di misura
Un elenco dei prefissi accettati nel Sistema Internazionale SI, per multipli e sottomultipli delle unità di misura. Ci sono anche semplici illustrazioni ed esempi del loro uso.
https://www.chimica-online.it/download/multipli-sottomultipli.htm
lingua: italiano
Abbondanza di elementi chimici nell’universo
Il sito del Prof. Roberto Bisceglia, nella sezione Didattica della Chimica, contiene molti materiali utili. Segnaliamo questa tavola della distribuzione degli elementi non solo nella crosta terrestre, ma anche nell’intero sistema solare, e ancora in altri ambienti.
https://www.bisceglia.eu/chimica/tabelle/abbondanza.html
lingua: italiano